ADENOVIRUS R-GENE®
Kit PCR real-time per il rilevamento e la quantificazione del DNA di Adenovirus
- Quantificazione accurata della carica virale di ADENOVIRUS su un ampio range lineare
- Rilevamento di tutti i sierotipi conosciuti
- Kit pronto all’uso con controllo interno e standard di quantificazione
- CE-IVD su diversi tipi di campioni e su tutte le principali piattaforme di estrazione e i sistemi PCR real-time
Maggiori informazioni
Vantaggi di ADENOVIRUS R-GENE®
ADENOVIRUS è una complicanza grave per i pazienti immunocompromessi e provoca alti livelli di morbilità e mortalità. Il rilevamento e il monitoraggio ottimizzati dell’infezione da ADENOVIRUS sono quindi molto importanti per migliorare la gestione del paziente. ADENOVIRUS R-GENE® è la soluzione ideale poiché consente il rilevamento e/o la quantificazione del genoma di tutti i sierotipi di ADENOVIRUS conosciuti. Offre un rilevamento rapido e specifico per contribuire a tracciare il corso dell’infezione e a monitorare la risposta al trattamento. Per migliorare ulteriormente la completezza dei test, la maggior parte dei test della gamma R-GENE® consente di quantificare diversi patogeni in un campione o di analizzare contemporaneamente diversi campioni per un virus.
- Sensibile e riproducibile
- Misurazione affidabile dell’infezione da ADENOVIRUS
- Ampio range lineare
- Standardizzato
- Profili di test armonizzati per analisi multiple in un solo ciclo
- Processazione uniforme con la gamma di prodotti R-GENE® (CMV R-GENE®, HSV1 HSV2 VZV R-GENE®, CMV HHV6,7,8 R-GENE®, BK Virus R-GENE®, EBV R-GENE®, Parvovirus B19 R-GENE®, BORDETELLA R-GENE®)
- Flessibile
- Validato per l’uso con vari tipi di campioni
- Preparazione manuale del campione o uso di preparatori automatici come NucliSENS® easyMAG® e tecniche di preparazione dell’analisi come easySTREAM™
- Qualificato per le principali piattaforme per PCR real-time
Tutto il necessario in un solo kit
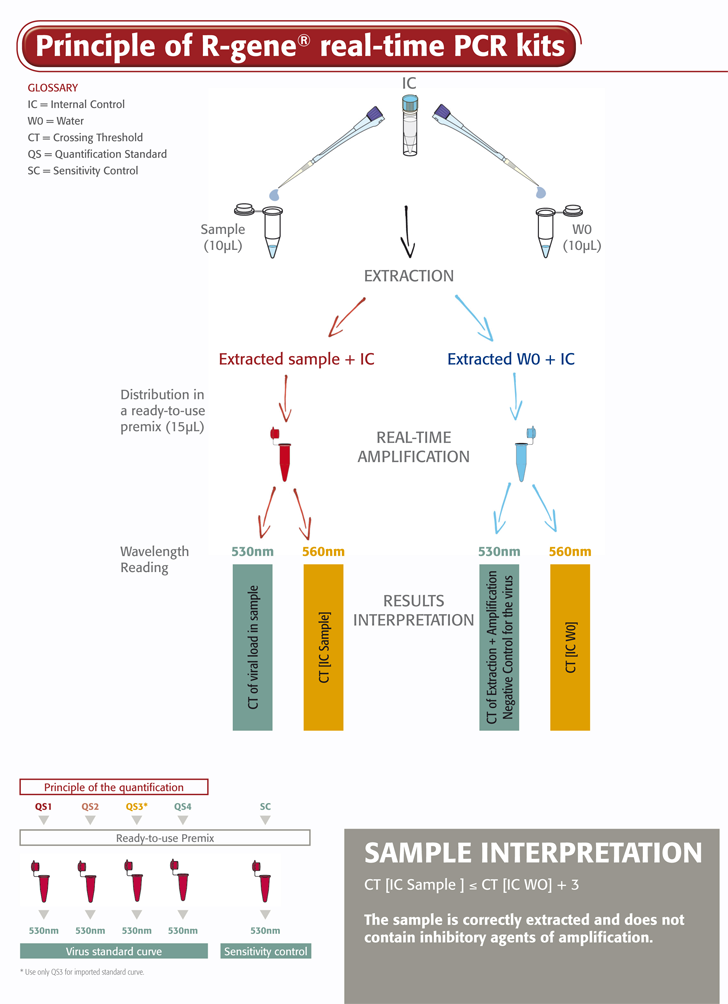
Il kit ADENOVIRUS R-GENE® è un test molecolare pronto all’uso progettato per rilevare e quantificare la carica virale di ADENOVIRUS tramite PCR real-time dopo l’estrazione del DNA virale. Analisi basata sull'attività 5’ nucleasica, amplifica una regione specifica del genoma di ADENOVIRUS.
- Quattro standard di quantificazione garantiscono una misurazione accurata della carica virale di ADENOVIRUS
- Un controllo di sensibilità convalida le prestazioni dell’analisi nella routine di laboratorio
- Un controllo interno (IC2) verifica il processo di estrazione, lisi compresa, e la presenza di inibitori dell’amplificazione nel campione
- Include tutti i reagenti necessari ottimizzati per il rilevamento e la quantificazione di ADENOVIRUS per uso diagnostico in vitro
Procedura semplice
Il kit ADENOVIRUS R-GENE® è semplice da utilizzare. Basta aggiungere il campione di DNA estratto alla master mix PCR pronta all’uso e iniziare la reazione sul termociclatore PCR real-time appropriato, seguendo il programma ottimizzato dei cicli descritto nelle “Istruzioni per l’uso”.
BIOMERIEUX, il logo blu, ARGENE®, R-GENE®, EASYMAG® e NUCLISENS® sono marchi utilizzati, depositati o registrati di proprietà di bioMérieux, o di una delle sue controllate o aziende.
Qualsiasi altro nome o marchio è di proprietà dei rispettivi titolari.
| ADENOVIRUS R-GENE® (69-010B) | |
|---|---|
| Principio del test | Rilevamento e quantificazione del genoma di ADENOVIRUS |
| Informazioni per l’ordinazione | Codice 69-010B: ADENOVIRUS R-GENE® Kit di rilevamento e quantificazione Disponibile anche con il codice 69-010: ADENOVIRUS R-GENE® Kit di rilevamento e quantificazione COMPLETO (include il kit di quantificazione 69-010B e il kit di estrazione del DNA cod. 67-000) |
| Tecnologia | PCR real-time / tecnologia Taqman 5’ nucleasi |
| Target genico | GENE Hexon |
| Campione* | Sangue intero, plasma, LCS, feci, biopsie, campioni oculari, campioni respiratori (aspirati nasofaringei, BAL, tamponi nasali) |
| Limite di rilevazione | Sangue intero: 8 copie/PCR (200 copie/ mL) Campioni nasali: 10 copie/PCR (261 copie/ mL) Sangue intero: 550 copie/mL Secrezioni nasali: 670 copie / mL |
| Range dinamico di quantificazione | Sangue intero: da 2,58 103 copie/mL a 4,65 1010 copie/mL Campione nasofaringeo: da 5,19 103 copie/mL a 8,25 1010 copie/mL Fino a 5X106 copie/ mL |
| Controlli inclusi | Controllo di estrazione + inibizione, controllo di sensibilità, controllo negativo |
| Risultati in | 75 minuti (passaggio di estrazione escluso) |
| Unità di riferimento | Copie/mL |
| Numero di test | 90 test |
| Condizioni di conservazione | -18°C/-22°C per codice 69-010B (kit di quantificazione), +2°C/+8°C per codice 67-000 (kit di estrazione DNA) |
| Piattaforma di estrazione* validata | |
| Manuale | QIAamp DNA Blood Mini kit QIAamp DNA Stool Mini kit QIAcube |
| Automatizzato | NUCLISENS® EASYMAG® QIAsymphony MagNA Pure LC MagNA Pure Compact MagNA Pure 96 Biorobot M48 m2000sp VERSANT kPCR Molecular System SP |
| Piattaforma di amplificazione validata* | Life Technologies (ABI7500, ABI7500 Fast & StepOne) LightCycler 1.0 LightCycler 2.0 LightCycler 480 II SmartCycler 2.0 RotorGENE VERSANT kPCR Molecular System AD Biorad DX Real-Time system StrataGENE / Agilent |
| Stato | Per uso diagnostico in vitro, marchio CE in Europa |
* si prega di verificare
Informazioni chiave su ADENOVIRUS
Cos’è ADENOVIRUS?
Gli ADENOVIRUS sono virus icosaedrici di medie dimensioni, a DNA a doppio filamento, privi di envelope. Sono state descritte almeno sette specie di ADENOVIRUS umano (A-G), 52 sierotipi. Gli ADENOVIRUS possono provocare patologie respiratorie, oculari o gastrointestinali, che si verificano principalmente nei bambini e nelle reclute militari come infezioni endemiche o durante le epidemie. Le infezioni da ADENOVIRUS sono comuni e si verificano durante tutto l’anno, in tutto il mondo.
Quali sono i soggetti più a rischio?
Negli ultimi anni, gli ADENOVIRUS sono stati sempre più riconosciuti come patogeni virali significativi con elevata morbilità e mortalità tra i pazienti immunocompromessi. Le manifestazioni cliniche nei pazienti immunocompromessi includono polmonite, epatite, cistite emorragica, colite, pancreatite, meningoencefalite e patologia diffusa, a seconda della malattia sottostante, del sistema colpito, dell’età del paziente e del sierotipo del virus.
Quali sono i vantaggi dei test su ADENOVIRUS?
Le analisi basate su PCR real-time per ADENOVIRUS consentono il rilevamento rapido e specifico prima della comparsa dei sintomi clinici per contribuire al miglioramento degli esiti, particolarmente importante per i pazienti immunosoppressi che possono essere colpiti in modo grave. I test aiutano a tenere traccia dell’efficacia del trattamento attivo e possono essere utilizzati per monitorare eventuali recidive dopo il trattamento.
ADENOVIRUS R-GENE®: PUBBLICAZIONI
- Comparison of the EZ1 XL advanced and the Magna Pure instruments for the extraction of whole blood before DNA quantification of CMV, EBV, HHV 6 and ADENOVIRUS
Marie Gueudin, Alexandre Louvel, Jean-Christophe Plantier, Laboratoire de virologie, CHU de Rouen, Université de Rouen, France. ECV 2013 - Comparison of in-house real-time quantitative PCR to the ADENOVIRUS R-Gene kit for determination of ADENOVIRUS load in clinical samples.
Jeulin et al. Laboratory of Virology, Nancy University Hospital, France. J Clin Microbiol. 2010 Sep;48(9):3132-7. Epub 2010 Jul 14. - ADENOVIRUSes in Immunocompromised Hosts
Echavarria. Laboratory of Clinical Virology, University Hospital, Buenos Aires. Clinical Microbiology Reviews, Oct 2008, 704-715 - Analytical and Clinical Evaluation of the Argene ADENOVIRUS R-Gene Assay.
Malgorzata Kowerska et al. Department of Pathology and Laboratory Medicine, North Shore-LIJ Health System Laboratories, NY. CVS 2011 - Prognostic value of qPCR for ADENOVIRUS detection in stool samples compared with antigen detection and cell culture in hematopoietic cell transplant recipients and evaluation of ADENOVIRUS R-gene™ kit
Jeulin et al. Laboratory of Virology, Nancy University Hospital, France. CVS 2010 - Outbreak of ADENOVIRUS keratoconjuntivitis in health care workers : coinfection with different ADENOVIRUS species.
Echavarria et al. Laboratory of Clinical Virology, University Hospital, Buenos Aires. CVS 2009 - Development of a new diagnostic tool for the quantification of ADENOVIRUSes by Real Time PCR.
Magro et al. ARGENE. ESCV 2010 - A commercial Real Time PCR for ADENOVIRUS
Echavarria et al. Laboratory of Clinical Virology, University Hospital, Buenos Aires. ESCV 2009 - Validation of commercial (ARGENE) FLU A/B, RSV A/B and ADENOVIRUS PCR assay.
Hocker et al. Scott&White Hospital/Texas A&M Health Science Center College of Medicine, Temple, Texas, USA. CVS 2009 - Detection of ADENOVIRUS DNA from Clinical specimens using commercial Real Time PCR reagents.
Zheng et al. Children's Memorial Hospital, Northwestern University, Chicago, Illinois. - Real-time PCR for the detection of respiratory viruses.
Seffar et al. Molecular Diagnostic Center, Laboratory of Virology, Erasme Hospital, Brussel, Belgium. ESCV 2009 - H.JEULIN, A.SALMON, P.BORDIGONI and V.VENARD
Comparaison of In-house Real-Time Quantitative PCR to the ADENOVIRUS R-Gene Kit for Determination of ADENOVIRUS Load in Clinical Samples
Journal of Clinical Microbiology, Sept.2010.p.3132-3137 - TATE JE, BUNNING ML, LOTT L, LU X, SU J, METZGAR D., BROSCH L., PANOZZO CA, MARCONI VC, FAIX DJ, PRILL M, JOHNSON B, ERDMAN DD, FONSECA V, ANDERSON LJ, WIDDOWSON MA
Outbreak of Severe Respiratory Disease Associated with Emergent Human ADENOVIRUS Serotype 14 at a US Air Force training Facility in 2007.
J Infect Dis. 15;199(10):1419-1426, May 2009 - ECHAVARRIA M.
ADENOVIRUSes in immuno compromised Host. Clinical Microbiology reviews, Oct 2008, p.704-715. - VABRET A., GOUARIN S., JOANNES M., BARRANGER C., PETITJEAN J., CORBET S., BROUARD J., DUHAMEL JF., GUILLOIS B. AND FREYMUTH F.
Development of a PCR and hybridization-based assay (PCR ADENOVIRUS CONSENSUS) for the detection and the species identification of ADENOVIRUSes in repiratory specimens.
J.Clin virology 31(2):116-22, Oct 2004. - HEIM A., EBNET C., HARSTE G., PRING-AKERBLON P.
Rapid and Quantitative Detection of Human ADENOVIRUS DNA by Real-Time PCR.
Journal of Medical Virology 70: 228-239, 2003.